close

近幾年生物醫學蓬勃發展,讓許多人期盼有一天科學家可以改變人類基因,達到治療疾病或延長壽命的目的,但其實要改變生物原有的基因不是容易的事。首先我們得找到需要修改的基因,但是人類染色體含有 30 億個鹼基,要從中找到某個特定鹼基來進行修改,比去中國找一個只知道名字卻不知道下落的人還難上加難。
012 年以前科學家進行基因或 DNA 編輯的工具主要有兩種,一是 ZFN(Zinc Finger Nuclease);另一種是 TALEN(Transcription Activator-Like Effector Nuclease)。這兩者都是利用蛋白質來標定 DNA 的位置,然後利用 FokI 核酸酶剪斷要編輯的基因,再進行插入或移除。不過 ZFN 和 TALEN 用來辨識 DNA 位置的蛋白質都不容易製作,而且 ZFN 對細胞有毒性,TALEN 則因分子大不易高效導入,因此科學家往往要費九牛二虎之力才能編輯一個基因。這些困難要等到 CRISPR / Cas 出現才得以解決。
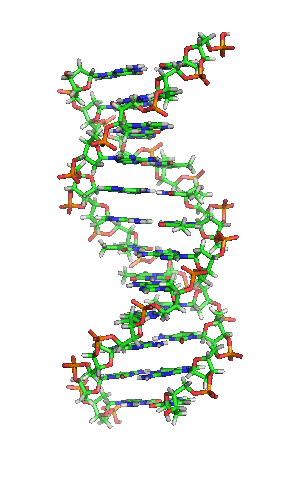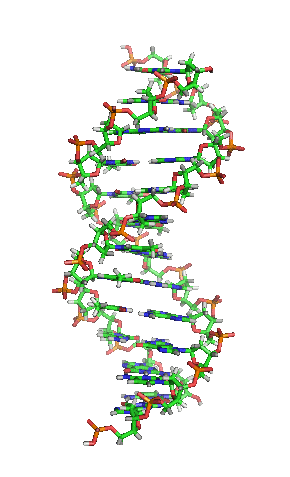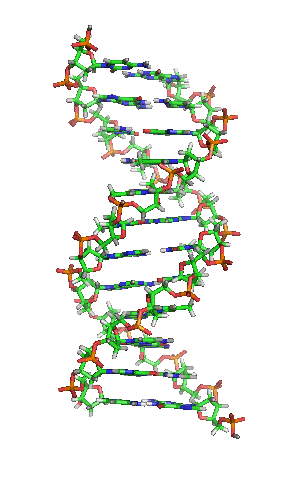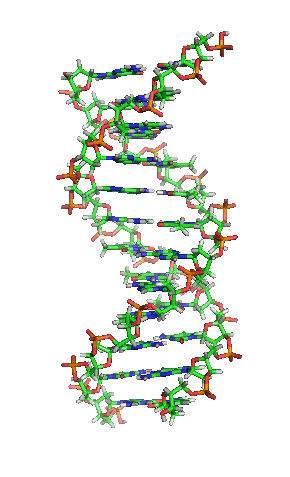
▲ 此為去氧核醣核酸片段結構動畫,各種鹼基水平排列於兩條螺旋長鏈之間。(Source:wikipedia)
漫長的發現過程
如果說 Photoshop 是相片編輯大師,那麼 CRISPR / Cas 系統就堪稱是 DNA 編輯大師了。
CRISPR / Cas 包含兩個部份,第一個是 CRISPR(clustered, regularly interspaced, short palindromic repeats),這是一段排列奇特的 DNA;第二個是 Cas,是一種核酸酶。這兩者組合起來就成為一套 DNA 編輯系統。這套系統的發現非常有趣,最初是 1987 年日本科學家 Y. Ishino 等人在大腸桿菌的 iap 基發現一段奇怪的 DNA,這段 DNA 是由兩個單元 repeat 和 spacer 不斷重複組成,當時他們不明白這段 DNA 有什麼意思,把它取了個名字叫 CRISPR。到了 2002 年,科學家發現 CRISPR 經常和 cas 基因連在一起,因此把這一段 DNA 合稱 CRISPR / Cas。
2005 年 C. Pourcel 發現 CRISPR中的 spacer 來自曾攻擊細菌的病毒。兩年後 R. Barrangou 終於解開了這段 DNA 的謎:原來 CRISPR / Cas 系統是細菌抵抗病毒攻擊的一套免疫系統。當病毒攻擊細菌後,如果細菌沒死,便會把病毒遺留下來的 DNA 片段加到自己的 CRISPR 成為一段 spacer,所以如果一隻細菌曾遭受 10 次不同病毒攻擊,便會增加 10 個 spacer。等到下一次再遭受病毒攻擊時,細菌的 CRISPR / Cas 便會比對病毒的 DNA 序列,如果和某個 spacer 一模一樣,那就表示這隻病毒曾經來犯過,Cas 核酸酶便會將這個病毒的 DNA 剪斷,使病毒失去攻擊細菌的能力。
到底 CRISPR如何比對病毒 DNA 呢?2008 年 S.J.J. Brouns發現細菌原來是由 CRISPR轉錄的一段特別 RNA 來比對病毒 DNA 序列,這段 RNA 稱作 crRNA。事實上 CRISPR除了使用 crRNA 來比對外,有時還需要另一段特別的 RNA (tracrRNA)來輔助尋找病毒 DNA。目前知道 CRISPR / Cas 系統可以粗略分成三大類:Type I、II、III。其中 Type I、III 只需要 crRNA 就可以找到病毒 DNA ;而 Type II 則需要 crRNA 和 tracrRNA 合作才能找到。不過 Type I、III 如果要切斷病毒的 DNA,需要 8 種 Cas;而 Type II 只需要一種(Cas9)即可,因此 type II 的 CRISPR / Cas9 受到科學家的青睞全力發展。
3 種 DNA 編輯工具比較

CRISPR / Cas9的功能
如果把 DNA 編輯技術與半導體發展做對照,ZFN 的技術層次就像是真空管,TALEN 則是電晶體,而 CRISPR / Cas9 就邁入積體電路時代,因此 CRISPR / Cas9 可稱為近年生物學界的最大突破。
2012 年可說是 CRISPR / Cas9 系統大豐收的一年。I. Yosef 發現病毒 DNA 上有一段特別的區域叫 PAM,可以被 crRNA 用來加強辨識 DNA 位置。美國加大柏克萊分校的蔣內可(M. Jinek)把 crRNA 和 tracrRNA 黏起來,變成一條合成的單股RNA,稱 sgRNA,大幅簡化製作 CRISPR / Cas9 的過程,同年他又提出修改 sgRNA 裁切其他 DNA 的方法。瑞典Umeå 大學的夏虹緹(E. Charpentier)和美國加大柏克萊分校的杜德娜(J. Doudna)正式提出了 CRISPR/ Cas9 這套可程式化的細菌免疫系統。2013 年哈佛-麻省理工博德研究所(Broad Institute)的合成生物學家張鋒(Feng Zhang),將這套系統用於哺乳動物多個基因(multiplex)的編修,並獲得成功。
張鋒的研究非常重要,因為以往的 ZFN 和 TALEN 有個大缺點,只能在每次實驗中改變一個基因,但是動物的表現型大多由多個基因所控制,例如人類的身高、膚色以及大部份的疾病,對於這些需求,ZFN 和 TALEN 毫無用武之地,而 CRISPR / Cas9 系統則沒有這個限制,因此能夠大幅放寬應用範圍。
CRISPR / Cas9 價格便宜、操作簡單,一般實驗室幾乎都能依照指示展開實驗,自 2012 年後相關的研究如雨後春筍冒出,據統計 2013 年有 277 篇科學研究;2014 年有 587 篇;2015 年預計會有 1,100 篇以上的論文。可以預見諾貝爾獎將會頒發給發現這套系統的相關研究者。
CRISPR / Cas9 也牽涉到龐大的經濟利益,無數的新藥開發和疾病治療都牽涉到 DNA 的編輯,據估計相關的商機有幾百億美元。基於上述種種因素,各方人馬無不盡力要證明自己是 CRISPR / Cas9 的第一位發現者,其中競爭最激烈的就是杜德娜和張鋒的團隊。
挑起專利訴訟和諾貝爾獎的爭奪戰火
2014 年 4 月美國專利商標局發給張鋒第一個 CRISPR 的專利,這項專利涵蓋了所有真核細胞,也就是除了細菌以外的所有生物。這消息讓杜德娜和夏虹緹非常不滿,因為她們比張鋒早了 7 個月申請 CRISPR 專利,卻遲遲得不到回應。為什麼張鋒後申請卻先得到回覆?這其中有兩個關鍵原因。
第一、原來美國專利商標局有一種加速專利申請的方法叫 track one,一般專利申請審核都會超過 12 個月,但是使用 track one 則保證 6 個月內給答案。當然天下沒有白吃的午餐,使用 track one 必須繳交很多錢。張鋒的團隊有個哈佛大學富爸爸,替他們付了這筆錢。
第二、由論文發表的時間點來看,杜德娜和夏虹緹是 2012 年 6 月發表於 Science,而張鋒則等到 2013 年 1 月才發表在同雜誌,明顯杜德娜才是首創。的確以現在美國專利商標局的規定「first to file」的人,即杜德娜和夏虹緹才能獲得專利;但是張鋒申請專利時美國用的是舊規定,即「first to invent」的人獲得專利,也就是只要你能證明自己是第一個想到的人就可以獲得專利。張鋒在專利申請書上附上了 2012 年初的實驗室筆記──早於杜德娜的 6 月──證明自己早就有這個想法。
現在張鋒和杜德娜兩人勢同水火,大戰才剛拉開序幕。杜德娜在張鋒獲得專利後,馬上退出她與張鋒共同成立的 Editas 公司,轉投敵營 Intellia。杜德娜在 YouTube 親自錄製影片介紹 CRISPR / Cas9;張鋒則做了一個網站 addgene 推廣他們 lab 的 CRISPR plasmids。今年 4 月杜德娜背後的加州大學,要求專利商標局撤銷張鋒代表的哈佛-麻省理工博德研究所 10 項有關 CRISPR / Cas9 的專利。據估計這場專利大戰沒有 3、5 年是不會落幕的。
(Source:YouTube)
醫療潛力無窮盡
不管張鋒和杜德娜之爭結果如何,CRISPR / Cas9 將會帶給人類巨大的改變。最新的研究顯示可以用這套系統將人類 T 細胞一種表面抗原 CXCR4 去除,如此一來,愛滋病毒 HIV 便無法感染 T 細胞;此外也成功地運用這種技術,治癒患有裘馨氏肌肉萎縮症的老鼠。雖然現在 CRISPR / Cas9 使用在人類身上還有許多技術問題需要克服,如效率太低、馬賽克效應(mosaic effect)、脫靶效應(off-target effect)等,各國法規和倫理也有諸多限制,不過假以時日這些問題終將被一一解決,屆時聖經創世紀第一章「神就照著自己的形象造人」可能要被改寫成「人就照著自己的想像造完美的人」。
文章來源: TechNews科技新報 http://technews.tw/2015/09/02/about-dna-crisprcas/
文章來源: TechNews科技新報 http://technews.tw/2015/09/02/about-dna-crisprcas/
文章標籤
全站熱搜


 留言列表
留言列表